BIFIDO NON DEVE MORIRE: SALVAGUARDARE IL MICROBIOTA INTESTINALE GRAZIE AD UN INNOVATIVO CEPPO BIFIDOBATTERICO RESISTENTE AD AMOXICILLINA + ACIDO CLAVULANICO
Che gli antibiotici siano uno strumento fondamentale è universalmente riconosciuto.
Questi farmaci alle volte sono gli unici in grado di sconfiggere le infezioni batteriche e migliorare le condizioni di salute di chi ne è affetto. Tuttavia, essi sono anche la causa di una riduzione del numero di batteri commensali, tutti quei batteri che sono naturalmente presenti e che non causano danni, e, al contrario, possono contribuire ai meccanismi di difesa dell’organismo, ricoprendo un ruolo di cruciale importanza per un intestino sano.
Nel corso di una vita, il microbiota intestinale può essere esposto anche frequentemente all’uso di antibiotici. Questo determina ogni volta una riduzione nelle popolazioni batteriche e quindi un’alterazione dell’ecosistema microbiota, con effetti di tipo immediato, ma anche con effetti indiretti a lungo termine sulla salute dell’ospite. In quest’ultimo contesto si inseriscono peraltro le numerose e recenti ricerche che studiano la relazione tra l’esposizione precoce agli antibiotici, la composizione del microbiota e la salute infantile.
Purtroppo, l’utilizzo dei più comuni probiotici durante la terapia antibiotica non è una buona opzione per tamponare il calo di batteri buoni, poiché i prodotti in commercio spesso non presentano caratteristiche che permettano di resistere all’attività degli antibiotici impiegati, venendo anch’essi travolti dall’azione battericida di questi farmaci.
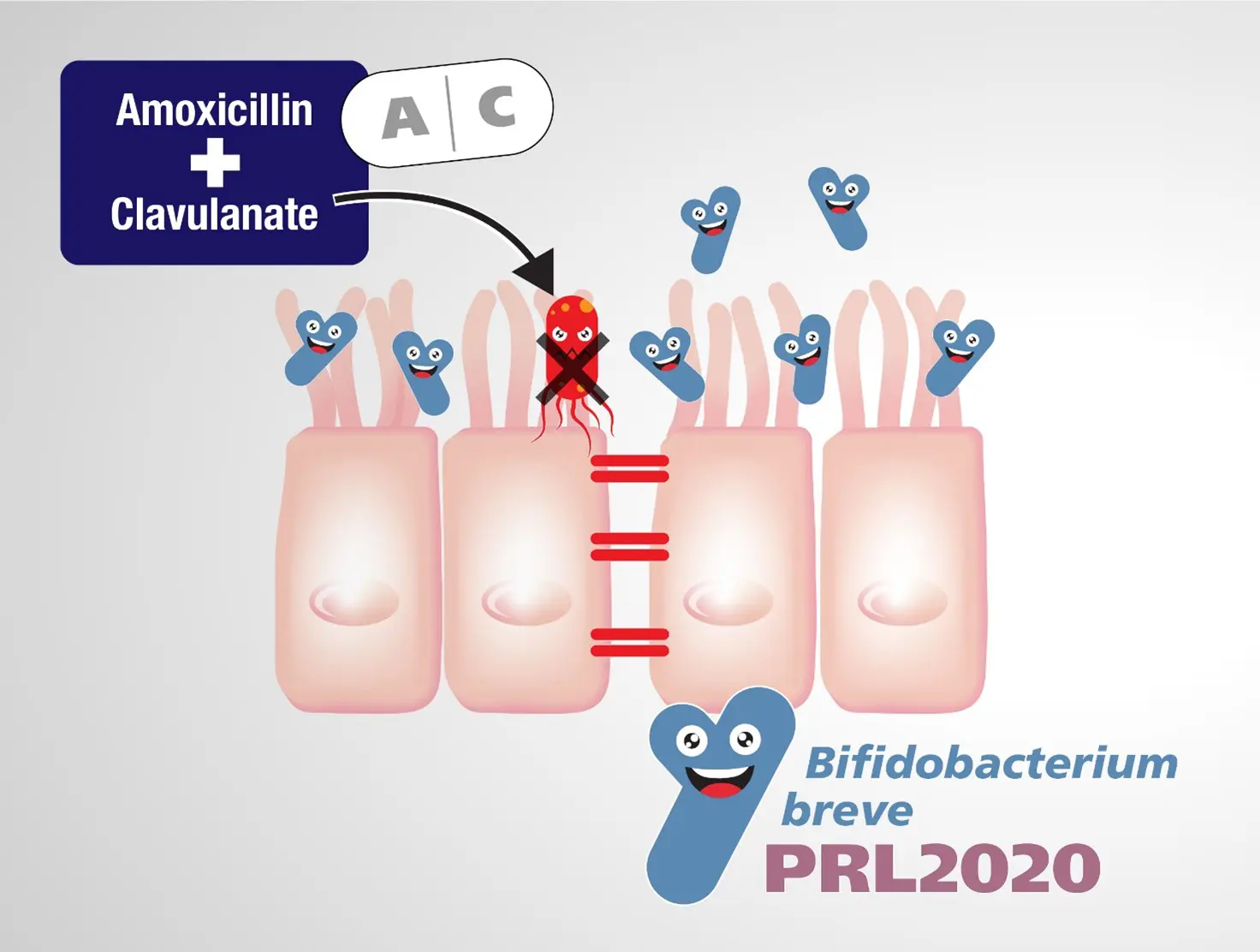
L’amoxicillina + acido clavulanico (AMC) è uno degli antibiotici più frequentemente prescritti nel mondo occidentale. Esso è un antibiotico ad ampio spettro e come tale è in grado di eliminare sia i batteri Gram-positivi che Gram-negativi. Uno studio del 2021 ad opera di un gruppo di ricerca italiano impegnato nello studio della genomica microbica* ha investigato specificamente l’impatto di questa formulazione antibiotica sul microbiota intestinale, rilevando una drastica riduzione dei batteri nei bambini trattati con amoxicillina + acido clavulanico rispetto al gruppo di controllo, comportando il dimezzamento del contenuto totale di bifidobatteri, popolazione batterica di importanza significativa per il benessere dell’uomo.
Questo dato ha stimolato la ricerca di un ceppo bifidobatterico che sia in grado di resistere ad AMC per investigarne la possibilità di impiego come probiotico da assumere utilmente già in concomitanza di questa terapia antibiotica per ripopolare precocemente il microbiota.
Il gruppo di ricerca ha quindi eseguito opportuni esperimenti per sondare la minima concentrazione inibente dell’amoxicillina + acido clavulanico (MICAMC) per diversi ceppi bifidobatterici, alcuni appartenenti ad una collezione di ceppi noti e altri isolati da bambini trattati con AMC nell’ambito della stessa ricerca. La determinazione della sensibilità/resistenza di questi ceppi di bifidobatteri intestinali ha mostrato che il 98,5% di essi è sensibile ad AMC.
Solo pochissimi ceppi hanno mostrato di poter resistere ad AMC, tra questi il Bifidobacterium breve PRL2020 ha mostrato il valore di resistenza più alto.
Simulando esperimenti sul microbiota intestinale è emerso che il ceppo PRL2020 è in grado di sopravvivere in presenza di un microbiota complesso combinato con l’antibiotico AMC.
Come passaggio successivo è stata confermata la totale sicurezza di questo ceppo batterico, appurando tra l’altro la sua incapacità di trasferire questa peculiare resistenza ad altri batteri. cosa che ridurrebbe l’efficacia della terapia antibiotica.
Questi risultati hanno supportato la tesi riguardante la capacità del B. breve PRL2020 di crescere in presenza di amoxicillina + acido clavulanico con il beneficio di ripopolare il microbiota intestinale di bifidobatteri benefici rendendo questo ceppo un candidato interessante per lo sviluppo di un nuovo prodotto probiotico da utilizzare quando viene prescritta la terapia con AMC e prevenire il drastico calo dei bifidobatteri che questa abitualmente comporta.
* Mancabelli L, Mancino W, Lugli GA, Argentini C, Longhi G, Milani C, Viappiani A, Anzalone R, Bernasconi S, van Sinderen D, Ventura M, Turroni F. Amoxicillin-Clavulanic Acid Resistance in the Genus Bifidobacterium. Appl Environ Microbiol. 2021 Mar 11;87(7):e03137-20. doi: 10.1128/AEM.03137-20. PMID: 33483308; PMCID: PMC8091617.
